* 上記シミュレーションの気体分子はすべて同じ種類であり、分子の色は単に識別のためのものです。
気体分子運動論
気体分子運動論は気体分子の運動を説明するための仮説です。この仮説を説明するために、次のような仮定を満足させる理想気体を仮定します。 (위키백과)
- 気体分子は、質量は存在するが、体積はありません。
- 気体分子は、互いに力を与えられない。
- 気体分子が起こすすべての衝突は完全弾性衝突である。
- 気体は、任意の温度や圧力にも決して液化または昇華されない。
- 気体分子の平均分子運動エネルギーは絶対温度のみ比例し、分子の大きさ、形状、種類には影響を受けない。
気体分子の根二乗平均速度
壁の断面積がであり、長さがである箱の中に質量がである気体粒子が含まれています。
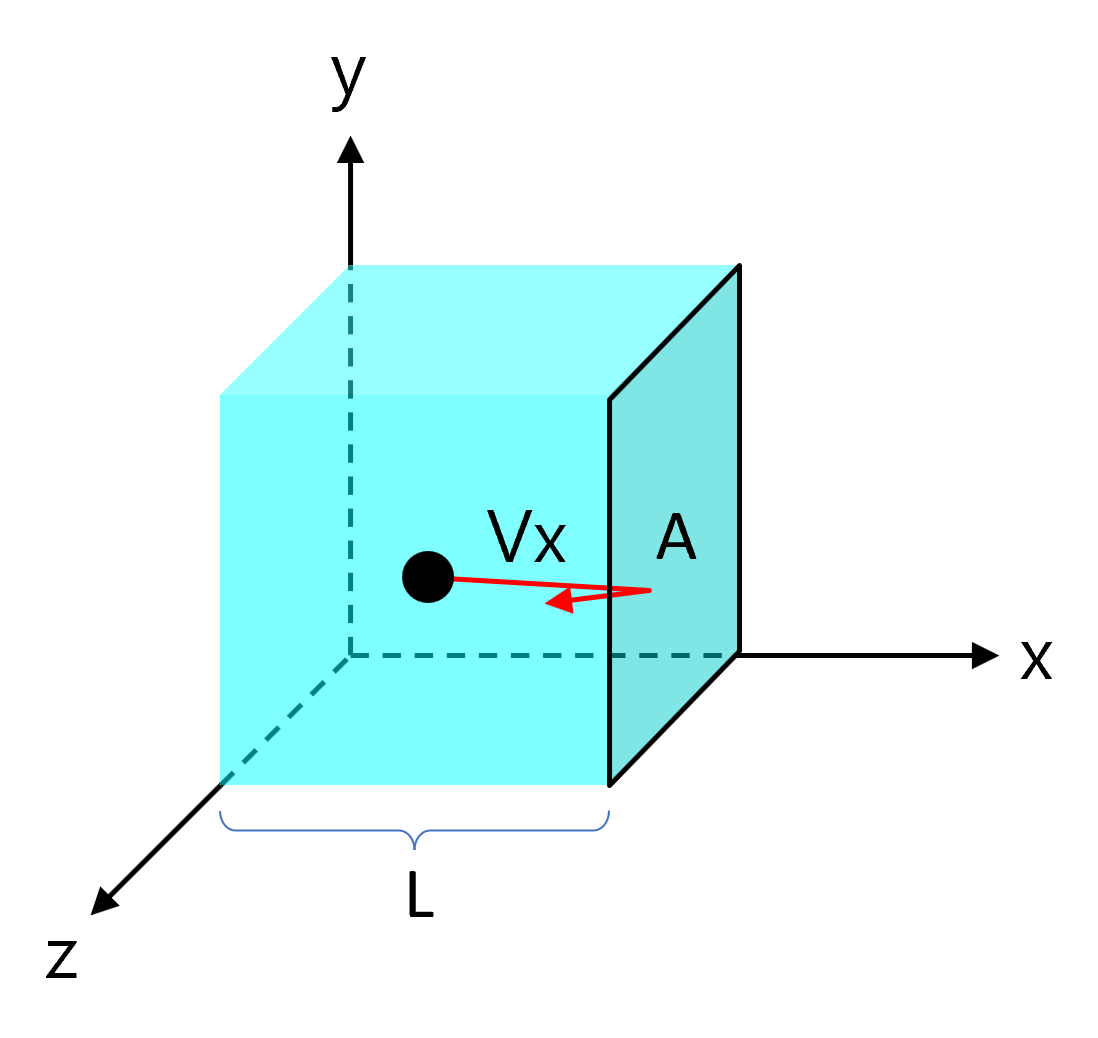
気体粒子は壁と完全弾性衝突し、、、軸方向に無秩序な直線運動をしています。
気体粒子がの速度を持って箱の面と衝突する場合を考えてみましょう。壁面に影響を与える運動は軸成分だけなので、利便性のためにしばらく軸と軸は思わない。
気体粒子は壁面と完全弾性衝突をします。衝突前後の粒子の運動量は、次のように変わります。
気体分子が箱の壁面と衝突した後、反対側の壁面と衝突して、再び壁面を衝突するの時間は、次のとおりです。
気体分子が毎秒壁面に加える衝撃力は、運動量の変化量を時間で分けて入手することができます。
壁面に加わる圧力は、単位面積当力として定義されるので、気体の圧力は、次のとおりです。(体積)
気体分子が2個以上の場合、気体分子が壁面に加える圧力の大きさは、次のとおりです。
= 気体分子の数
= 粒子の軸方向速度の二乗の平均値
パスカルの原理に沿って、気体の圧力は、すべての壁に渡って均一に適用されます。
したがって、上で求めた圧力は、単に壁面のみ該当するものではなく、箱全体の壁にも同様に適用されます。
さて、軸と軸方向を考慮してみましょう。気体粒子の速度の二乗()の平均は、ピタゴラスの定理として表すことができます。
理想気体分子の運動では、すべての軸で同じ自由度を持つため、次のように簡単に考えることができます。
したがって、箱の全体に加わる圧力は、次のとおりです。
気体粒子の全質量は、(=没収()×モル質量())としても表すことができます。
上記の結果は、理想気体の状態方程式()と一致する必要があります。
上記の式から二乗平均速度()は、絶対温度 に比例し、モル質量()に反比例することを知ることができます。
根二乗平均速度()は、二乗平均速度()に平方根をとったものです。
このように根二乗平均速度は、分子の種類や温度による関数として明確に定義することができ、一定の条件の下で、その値が変動していません。
気体分子の平均速度
平均速度は、気体分子の速度を算術平均として計算した値です。二分子が衝突したときに、運動量は保存されるが、平均速度はずっと変わります。気体粒子の数が十分に多いと仮定した平均速度 < >は、次のとおりです。(Maxwell-Boltzmann確率分布式から誘導、誘導過程は省略)
平均速度 < >は、根二乗平均速度 よりも少し小さい値を持ちます。
そして、平均速度は一定の値を維持していない、少しずつ変化します。分子の数が少なくなるほど変動が激しくなります。