- すべての原子モデルは最外殻の電子のみを示しています。
- すべての化学結合は平面で描かれていますが、実際には3次元構造を持つことができます。
- 「不安定な結合の場合、赤で表示」はエラーがある可能性があります。
化学結合
18族の不活性ガスを除いた原子は不安定なため、他の原子と結合した状態で存在します。 この時、ほとんどの原子はオクテット則を成す方向に結合しようとします。
オクテット則(Octet Rule)
オクテット則、または8電子規則と呼ばれるこの規則は、原子が安定した状態で存在できる経験的規則です。 つまり、分子を構成する各原子は、最外殻に8個の電子を持つと、最も安定した状態になるということです。
ただし、オクテット則にはいくつかの例外があります。
- 最も内側の殻は、電子が2つで安定しています。 例えば、原子番号1番水素は電子を1つだけ得れば安定し、3番リチウムは電子を1つだけ失ってしまうと安定します。 2番ヘリウムは世界で最も安定した原子です。
- 3周期からは、オクテット則を満たさなくても安定して存在する物質が登場します。 (例: H2SO4 (硫酸)、H3PO4 (リン酸)など)
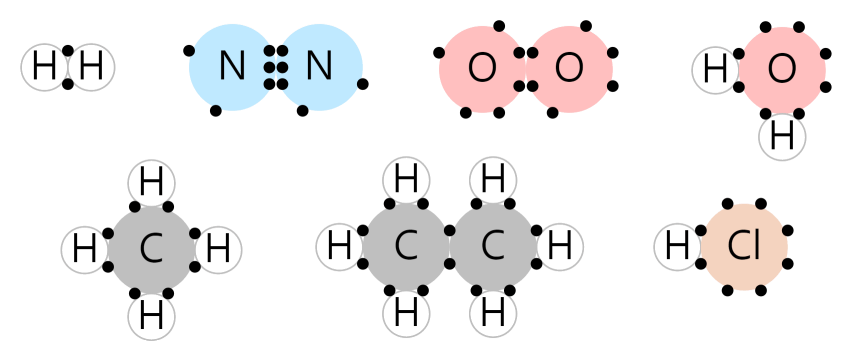
共有結合
共有結合は、原子が電子を互いに共有しながら、オクテット則を満たす場合です。
下の図は共有結合の例です。 原子間に挟まれている電子が共有電子です。 共有電子を含む電子をそれぞれ数えてみると、水素は2個、残りの原子は8個ずつであることがわかります。
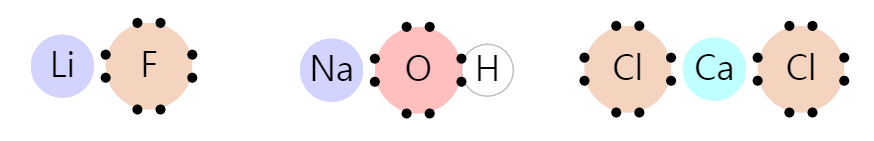
イオン結合
イオン結合は、電子を他の原子に一方的に提供しながら、オクテット則を満たす場合です。
原子の最外角電子が3個以下の場合、オクテット則を満たすためには5個以上の電子を集めなければなりません。 この場合、大量の電子を集めるのではなく、少数の電子をエクスポートするほうが有利であるからです。
下の図はイオン結合の例です。 リチウム(Li)、ナトリウム(Na)、カルシウム(Ca)は隣接する原子に電子を提供します。 リチウム(Li)、ナトリウム(Na)、カルシウム(Ca)は最外角電子をすべて取り除き、隣の原子はオクテット則を満たしています。